ユプリズナ点滴静注100mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
医薬品コード(YJコード):6399429A1026
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- イネビリズマブ(遺伝子組換え)注射液
- 英名(商品名)
- Uplizna
- 規格
- 100mg10mL1瓶
- 薬価
- 3,495,304.00
- メーカー名
- 田辺ファーマ
- 規制区分
- 劇薬
- 長期投与制限
- -
- 標榜薬効
- 免疫抑制薬〔抗CD19モノクローナル抗体〕
- 色
- -
- 識別コード
- -
- [@: メーカーロゴ]
- 添付文書
-
PDF 2025年12月改訂(第4版)
- 告示日
- 2021年5月18日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2021年6月版
- 医薬品マスタ削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
1). 視神経脊髄炎スペクトラム障害(視神経脊髄炎を含む)の再発予防。
2). IgG4関連疾患の再燃抑制。
(効能又は効果に関連する注意)
5.1. 〈視神経脊髄炎スペクトラム障害(視神経脊髄炎を含む)〉本剤は、視神経脊髄炎スペクトラム障害(視神経脊髄炎を含む)の患者に使用すること(「多発性硬化症・視神経脊髄炎スペクトラム障害診療ガイドライン2023」(日本神経学会)を参考にすること)。
5.2. 〈視神経脊髄炎スペクトラム障害(視神経脊髄炎を含む)〉抗アクアポリン4抗体陰性(AQP4抗体陰性)の患者において有効性を示すデータは限られている(本剤は、抗AQP4抗体陽性の患者に投与すること)〔17.1.1参照〕。
用法用量
通常、成人には、イネビリズマブ(遺伝子組換え)として1回300mgを初回、2週後に点滴静注し、その後、初回投与から6ヵ月後に、以降6ヵ月に1回の間隔で点滴静注する。
(用法及び用量に関連する注意)
7.1. 〈効能共通〉Infusion reactionのリスクを低減し症状をコントロールするため、本剤投与の30分~1時間前に抗ヒスタミン薬及び解熱鎮痛剤を経口投与にて、本剤投与の30分前に副腎皮質ホルモン剤を静脈内投与にて前投与し、患者の状態を十分に観察すること〔11.1.1参照〕。
7.2. 〈視神経脊髄炎スペクトラム障害(視神経脊髄炎を含む)〉本剤の血中濃度低下により再発のおそれがあるため、投与間隔を遵守すること。
7.3. 〈視神経脊髄炎スペクトラム障害(視神経脊髄炎を含む)〉本剤を一定期間投与後、再発の頻度について検討し、再発の頻度の減少が認められない患者では、本剤の投与中止を検討すること。
7.4. 〈IgG4関連疾患〉本剤の血中濃度低下により再燃のおそれがあるため、投与間隔を遵守すること。
7.5. 〈IgG4関連疾患〉本剤を一定期間投与後、再燃の頻度について検討し、再燃の頻度の減少が認められない患者では、本剤の投与中止を検討すること。
改訂情報
2025年12月10日 DSU No.341 【その他】
【7.用法及び用量に関連する注意】(追記)
〈IgG4関連疾患〉
本剤の血中濃度低下により再燃のおそれがあるため、投与間隔を遵守すること。
【7.用法及び用量に関連する注意】(追記)
本剤を一定期間投与後、再燃の頻度について検討し、再燃の頻度の減少が認められない患者では、本剤の投与中止を検討すること。
【11.1重大な副作用】(一部改訂)
Infusion reaction:
アナフィラキシー、頭痛、悪心、傾眠、呼吸困難、発熱、筋肉痛、発疹、動悸等があらわれることがある。臨床試験において、infusion reactionは初回投与時に多く認められたが、2回目投与以降の投与時にも認められている。異常が認められた場合には投与中断、中止、投与速度を緩める等の対応を行い、適切な処置を行うこと。また、重度のinfusion reactionがあらわれた場合には直ちに投与を中止し、適切な処置を行うこと。
【11.2その他の副作用】(一部改訂)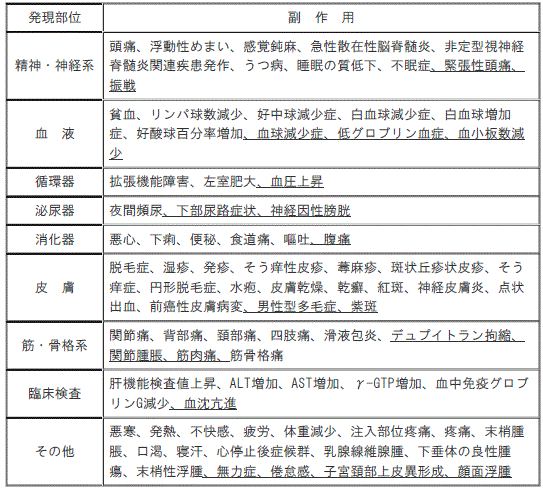
よく一緒に見られている薬
医師の処方により使用する医薬品。



 で医薬品を比較する
で医薬品を比較する
