プレバイミス錠240mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
医薬品コード(YJコード):6250048F1027
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- レテルモビル錠
- 英名(商品名)
- Prevymis
- 規格
- 240mg1錠
- 薬価
- 14,645.50
- メーカー名
- MSD
- 規制区分
- 劇薬
- 長期投与制限
- -
- 標榜薬効
- 抗サイトメガロウイルス薬
- 色
- 黄
- 識別コード
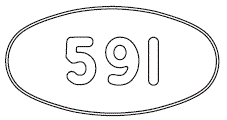
- (本体)@ (本体)591 (被包)PREVYMIS 240mg @591
- [@: メーカーロゴ]
- 添付文書
-
PDF 2025年10月改訂(第6版)
- 告示日
- 2018年5月21日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2018年6月版
- 医薬品マスタ削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
次記におけるサイトメガロウイルス感染症の発症抑制:1)同種造血幹細胞移植、2)臓器移植。
(効能又は効果に関連する注意)
〈臓器移植〉腎移植以外の臓器移植患者を対象に本剤の有効性及び安全性を評価する臨床試験は実施していない。
用法用量
通常、成人にはレテルモビルとして480mg(240mg錠2錠)を1日1回経口投与する。シクロスポリンと併用投与する場合にはレテルモビルとして240mg(240mg錠1錠)を1日1回経口投与する。
通常、小児にはレテルモビルとして次の用量を1日1回経口投与する。
1). 体重30kg以上:シクロスポリンの併用なしの場合480mg(240mg錠2錠)、シクロスポリンの併用ありの場合240mg(240mg錠1錠)。
2). 体重15kg以上30kg未満:シクロスポリンの併用なしの場合240mg(240mg錠1錠)。
(用法及び用量に関連する注意)
7.1. 〈効能共通〉経口剤(錠剤及び顆粒剤)と注射剤は医師の判断で切り替えて使用することができる。なお、体重30kg未満の小児では、切り替える際に用量の調節が必要となる場合がある。
7.2. 〈効能共通〉サイトメガロウイルス血症又はサイトメガロウイルス感染症が確認された場合には、本剤の投与を中止し、サイトメガロウイルスに対する治療等、適切な対応を行うこと〔17.1.1-17.1.5参照〕。
7.3. 〈同種造血幹細胞移植〉同種造血幹細胞移植の移植当日から移植後28日目までを目安として投与を開始すること(投与期間は、患者のサイトメガロウイルス感染症の発症リスクを考慮しながら、移植後200日目までを目安とすること)〔17.1.1-17.1.3参照〕。
7.4. 〈臓器移植〉移植後早期より投与を開始し、投与期間は、患者のサイトメガロウイルス感染症の発症リスクを考慮しながら、移植後200日目までを目安とすること(ただし、レテルモビルは主に肝を介して消失するため、移植後に肝機能が安定しない場合、血漿中濃度が上昇するおそれがあることから、投与可否を慎重に判断すること)〔9.3.1、16.6.2、17.1.4、17.1.5参照〕。
外形画像

改訂情報
2025年4月22日 DSU No.335 【その他】
【6.用法及び用量】(一部改訂)
通常、成人にはレテルモビルとして480mg(240mg錠2錠又は120mg顆粒4包)を1日1回経口投与する。シクロスポリンと併用投与する場合にはレテルモビルとして240mg(240mg錠1錠又は120mg顆粒2包)を1日1回経口投与する。
通常、小児にはレテルモビルとして以下の用量を1日1回経口投与する。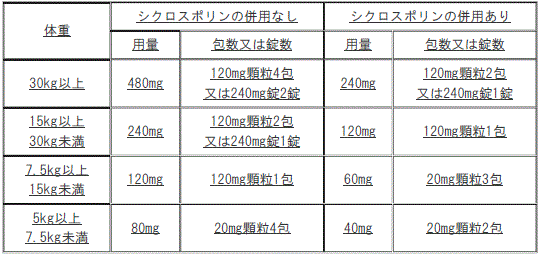
【7.用法及び用量に関連する注意】(一部改訂)
〈効能共通〉
経口剤(錠剤及び顆粒剤)と注射剤は医師の判断で切り替えて使用することができる。なお、体重30㎏未満の小児では、切り替える際に用量の調節が必要となる場合がある。
【9.7小児等】(一部改訂)
〈臓器移植〉
小児等を対象とした臨床試験は実施していない。
【14.適用上の注意】(追記)
[薬剤交付時の注意]
〈顆粒剤〉
スティックパックのまま保存し、服用直前にスティックパックから取り出すよう指導すること。
【14.適用上の注意】(追記)
本剤は軟らかい食品に混ぜて経口投与することが望ましい。また、経口投与が困難な場合は経鼻又は胃瘻チューブを介して投与できる。患者又は保護者等に対し、患者用説明文書を参照するよう指導すること。
・経鼻又は胃瘻チューブを介して投与する場合、本剤を室温の液体注)が入った容器に入れて10分程度静置する。顆粒が崩壊した後にシリンジで混合して、全量をシリンジ、及び経鼻又は胃瘻チューブを用いて投与する。
・その後、容器やシリンジを室温の液体注)ですすぎ、すすいだ全量をシリンジ、及び経鼻又は胃瘻チューブを用いて投与する。
・最後に、経鼻又は胃瘻チューブに水を流して投与する。
注)胃瘻チューブを介して投与する場合、チューブ内に本剤が残存する可能性があるため、水の使用は推奨されない。
医師の処方により使用する医薬品。



 で医薬品を比較する
で医薬品を比較する
