トロデルビ点滴静注用200mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- サシツズマブ ゴビテカン(遺伝子組換え)注射用
- 英名(商品名)
- Trodelvy
- 規格
- 200mg1瓶
- 薬価
- 187,195.00
- メーカー名
- ギリアド・サイエンシズ
- 規制区分
- 劇薬
- 長期投与制限
- -
- 標榜薬効
- 抗悪性腫瘍薬〔DNAトポイソメラーゼ1阻害薬結合抗TROP−2ヒト化モノクローナル抗体〕
- 色
- -
- 識別コード
- -
- [@: メーカーロゴ]
- 添付文書
-
PDF 2025年11月改訂(第2版)
- 告示日
- 2024年11月19日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2024年12月版
- 医薬品マスタ削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
化学療法歴のあるホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌。
(効能又は効果に関連する注意)
5.1. タキサン系抗悪性腫瘍剤による治療歴のある患者を対象とすること。
5.2. 臨床試験に組み入れられた患者における前治療歴等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.1、17.1.2参照〕。
5.3. 本剤の術前・術後薬物療法における有効性及び安全性は確立していない。
用法用量
通常、成人には、サシツズマブ ゴビテカン(遺伝子組換え)として1回10mg/kg(体重)を、21日間を1サイクルとし、各サイクルの1日目及び8日目に点滴静注する。投与時間は3時間とし、初回投与の忍容性が良好であれば、2回目以降は1~2時間に短縮できる。なお、患者の状態により適宜減量する。
(用法及び用量に関連する注意)
7.1. 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.2. 本剤投与時にあらわれることがあるinfusion reactionを軽減させるために、本剤の投与前に解熱鎮痛剤、抗ヒスタミン剤及びH2受容体拮抗剤の前投与を考慮すること〔8.2、11.1.3参照〕。
7.3. 本剤投与により副作用が発現した場合には、次の基準を考慮して、休薬、減量又は中止すること(副作用により本剤を減量した場合には、再増量しないこと)〔8.1、8.2、11.1.1-11.1.3参照〕。
[減量時の投与量の目安]
1). 通常用量:1回10mg/kg。
2). 1段階減量:1回7.5mg/kg。
3). 2段階減量:1回5mg/kg。
4). 3段階減量:投与中止。
[投与基準]
投与基準は好中球数が各サイクルの第1日目1500/mm3以上、第8日目1000/mm3以上(各サイクルの第8日目の投与予定日に1000/mm3未満で1週間を超えて1000/mm3以上に回復しない場合、次回は1500/mm3以上に回復してから再開する)。
[副作用による用量調節の目安]
1). 好中球減少症:
①. 次のいずれかの場合
a. 好中球減少症<Grade4が7日間以上継続>:投与基準に回復後、同一用量で又は1段階減量して再開できる(副作用が再発した場合は、投与基準に回復後、減量時の投与量の目安に従って再発ごとに1段階減量又は投与を中止する)。
b. 好中球減少症<Grade4かつ臨床的に必要>:投与基準に回復後、同一用量で又は1段階減量して再開できる(副作用が再発した場合は、投与基準に回復後、減量時の投与量の目安に従って再発ごとに1段階減量又は投与を中止する)。
c. 発熱性好中球減少症:投与基準に回復後、同一用量で又は1段階減量して再開できる(副作用が再発した場合は、投与基準に回復後、減量時の投与量の目安に従って再発ごとに1段階減量又は投与を中止する)。
d. 投与予定日に好中球減少症<Grade3~4>であり、Grade1以下に回復するまで2~3週間の投与延期を要する:投与基準に回復後、同一用量で又は1段階減量して再開できる(副作用が再発した場合は、投与基準に回復後、減量時の投与量の目安に従って再発ごとに1段階減量又は投与を中止する)。
②. 投与予定日に好中球減少症<Grade3~4>であり、Grade1以下に回復するまで3週間を超える投与延期を要する場合:投与を中止する。
2). 前記以外の血液毒性:
①. 投与予定日に前記以外の血液毒性<Grade3~4>であり、Grade1以下に回復するまで2~3週間の投与延期を要する場合:Grade1以下に回復するまで休薬し、減量時の投与量の目安に従って発現ごとに1段階減量又は投与を中止する。
②. 投与予定日に前記以外の血液毒性<Grade3~4>であり、Grade1以下に回復するまで3週間を超える投与延期を要する場合:投与を中止する。
3). 悪心、嘔吐又は下痢:
①. 制吐薬でコントロールできない悪心<Grade3~4>、制吐薬でコントロールできない嘔吐<Grade3~4>又は止瀉薬でコントロールできない下痢<Grade3~4>:Grade1以下に回復するまで休薬し、減量時の投与量の目安に従って発現ごとに1段階減量又は投与を中止する。
②. 投与予定日に悪心<Grade3~4>、嘔吐<Grade3~4>又は下痢<Grade3~4>であり、Grade1以下に回復するまで3週間を超える投与延期を要する場合:投与を中止する。
4). Infusion reaction:
①. 次記の場合を除くInfusion reaction<Grade1~3>:減速又は投与中断する。
②. 次のいずれかの場合
a. Infusion reaction<Grade4>:投与を中止する。
b. Infusion reaction<Grade2~3>かつ適切な治療にもかかわらず6時間以内に回復しないinfusion reactionが複数回認められる:投与を中止する。
5). 前記以外の非血液毒性:
①. 次のいずれかの場合
a. 前記以外の非血液毒性<Grade4>:Grade1以下に回復するまで休薬し、減量時の投与量の目安に従って発現ごとに1段階減量又は投与を中止する。
b. 前記以外の適切な医学的管理にもかかわらずGrade3かつ48時間を超えて持続する非血液毒性:Grade1以下に回復するまで休薬し、減量時の投与量の目安に従って発現ごとに1段階減量又は投与を中止する。
c. 投与予定日に前記以外の非血液毒性<Grade3>であり、Grade1以下に回復するまで2~3週間の投与延期を要する:Grade1以下に回復するまで休薬し、減量時の投与量の目安に従って発現ごとに1段階減量又は投与を中止する。
②. 投与予定日に前記以外の非血液毒性<Grade3~4>であり、Grade1以下に回復するまで3週間を超える投与延期を要する場合:投与を中止する。
GradeはNCI-CTCAEに準じる。
改訂情報
2025年12月10日 DSU No.341 【その他】
【7.用法及び用量に関連する注意】(一部改訂)
本剤投与により副作用が発現した場合には、次の基準を考慮して、休薬、減量又は中止すること。副作用により本剤を減量した場合には、再増量しないこと。
減量時の投与量の目安
【7.用法及び用量に関連する注意】(一部改訂)
副作用による用量調節の目安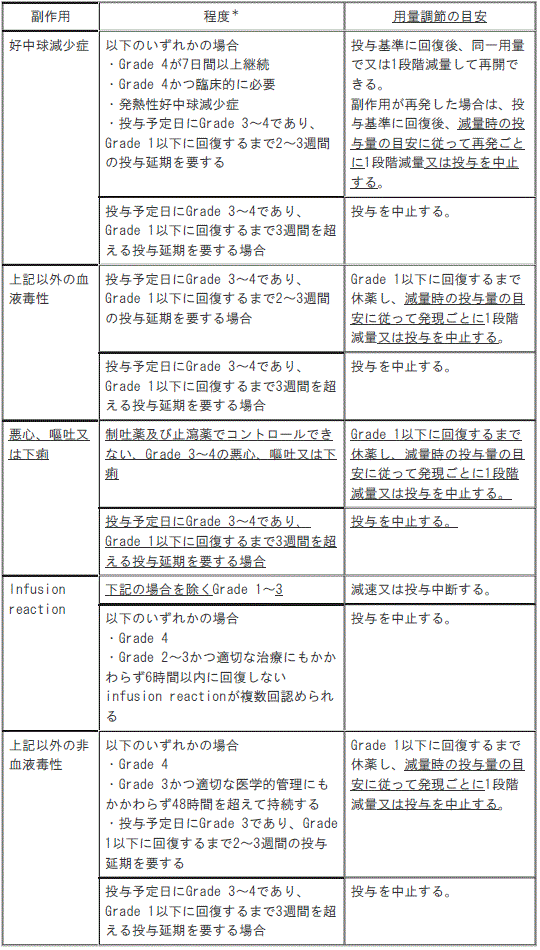
*:GradeはNCI-CTCAEに準じる。
【9.1合併症・既往歴等のある患者】(追記)
以下の発熱性好中球減少症のリスク因子を有する患者:
・65歳以上
・好中球減少症の既往歴
・Performance Status不良
・腎機能障害
・肝機能障害
・心血管系機能障害
・複数の合併症等
初回サイクルからG-CSF製剤の一次予防投与を考慮すること。本剤の複数の臨床試験において、好中球減少症に伴う致死的な感染症が、主に投与開始1~2サイクル目で認められている。
医師の処方により使用する医薬品。
特定薬剤管理指導加算等の算定対象となる薬剤。



 で医薬品を比較する
で医薬品を比較する
