ライブリバント点滴静注350mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- アミバンタマブ(遺伝子組換え)注射液
- 英名(商品名)
- Rybrevant
- 規格
- 350mg7mL1瓶
- 薬価
- 160,014.00
- メーカー名
- ヤンセンファーマ
- 規制区分
- 劇薬
- 長期投与制限
- -
- 標榜薬効
- 抗悪性腫瘍薬〔抗ヒトEGFR/抗ヒトMET完全ヒト型二重特異性モノクローナル抗体〕
- 色
- -
- 識別コード
- -
- [@: メーカーロゴ]
- 添付文書
-
PDF 2025年12月改訂(第4版)
- 告示日
- 2024年11月19日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2024年12月版
- 医薬品マスタ削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
1). EGFR遺伝子エクソン20挿入変異陽性の切除不能な進行・再発非小細胞肺癌。
2). EGFR遺伝子変異陽性の切除不能な進行・再発の非小細胞肺癌。
(効能又は効果に関連する注意)
5.1. 〈EGFR遺伝子エクソン20挿入変異陽性の切除不能な進行・再発非小細胞肺癌〉*十分な経験を有する病理医又は検査施設における検査により、EGFR遺伝子エクソン20挿入変異が確認された患者に投与すること(検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること)。
5.2. 〈EGFR遺伝子エクソン20挿入変異陽性の切除不能な進行・再発非小細胞肺癌〉臨床試験に組み入れられた患者の遺伝子変異の種類等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.1参照〕。
5.3. 〈EGFR遺伝子エクソン20挿入変異陽性の切除不能な進行・再発非小細胞肺癌〉本剤の術前・術後補助療法としての有効性及び安全性は確立していない。
5.4. 〈EGFR遺伝子変異陽性の切除不能な進行・再発の非小細胞肺癌〉*十分な経験を有する病理医又は検査施設における検査により、EGFR遺伝子変異(エクソン20挿入変異を除く)が確認された患者に投与すること(検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること)。
5.5. 〈EGFR遺伝子変異陽性の切除不能な進行・再発の非小細胞肺癌〉EGFRチロシンキナーゼ阻害剤による治療後に増悪した患者に対してカルボプラチン及びペメトレキセドナトリウムと併用する場合は、臨床試験に組み入れられた患者の前治療歴等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.3参照〕。
5.6. 〈EGFR遺伝子変異陽性の切除不能な進行・再発の非小細胞肺癌〉本剤の術前・術後補助療法としての有効性及び安全性は確立していない。
*)承認された体外診断用医薬品又は医療機器に関する情報については、次のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html。
用法用量
EGFR遺伝子エクソン20挿入変異陽性の切除不能な進行・再発の非小細胞肺癌にはA法、EGFR遺伝子変異(エクソン20挿入変異を除く)陽性の切除不能な進行・再発の非小細胞肺癌にはA法又はB法を使用する。
A法:カルボプラチン及びペメトレキセドナトリウムとの併用において、3週間を1サイクルとし、通常、成人にはアミバンタマブ(遺伝子組換え)として次の用法及び用量で点滴静注する。なお、患者の状態により適宜減量する。
1). 体重80kg未満:
①. 1サイクル目:1日目350mg、2日目1050mg、8日目、15日目1400mg。
②. 2サイクル目:1日目1400mg。
③. 3サイクル目以降:1日目1750mg。
2). 体重80kg以上:
①. 1サイクル目:1日目350mg、2日目1400mg、8日目、15日目1750mg。
②. 2サイクル目:1日目1750mg。
③. 3サイクル目以降:1日目2100mg。
B法:ラゼルチニブメシル酸塩との併用において、4週間を1サイクルとし、通常、成人にはアミバンタマブ(遺伝子組換え)として以下の用法及び用量で点滴静注する。なお、患者の状態により適宜減量する。
1). 体重80kg未満:
①. 1サイクル目:1日目350mg、2日目700mg、8日目、15日目、22日目1050mg。
②. 2サイクル目以降:1日目、15日目1050mg。
2). 体重80kg以上:
①. 1サイクル目:1日目350mg、2日目1050mg、8日目、15日目、22日目1400mg。
②. 2サイクル目以降:1日目、15日目1400mg。
(用法及び用量に関連する注意)
7.1. 本剤投与によるinfusion reactionを軽減させるため、本剤投与前に、1サイクル目の第1日目及び第2日目は、副腎皮質ホルモン剤、抗ヒスタミン剤及び解熱鎮痛剤を投与し、必要に応じてH2受容体拮抗剤や制吐剤を投与し、投与前に、1サイクル目の第8日目以降は、抗ヒスタミン剤及び解熱鎮痛剤を投与し、必要に応じて副腎皮質ホルモン剤、H2受容体拮抗剤や制吐剤を投与すること〔11.1.1参照〕。
7.2. 調製後の希釈液を次の速度で投与すること。
[本剤の投与量及び投与速度(カルボプラチン及びペメトレキセドナトリウムとの併用の場合)]
1). 体重80kg未満:
①. 1サイクル目:
a. 1日目:投与量350mg/250mL、投与速度(投与開始時)50mL/時、投与速度(投与開始2時間後)75mL/時。
b. 2日目:投与量1050mg/250mL、投与速度(投与開始時)33mL/時、投与速度(投与開始2時間後)50mL/時。
c. 8日目:投与量1400mg/250mL、投与速度65mL/時。
d. 15日目:投与量1400mg/250mL、投与速度85mL/時。
②. 2サイクル目:1日目:投与量1400mg/250mL、投与速度125mL/時。
③. 3サイクル目以降:1日目:投与量1750mg/250mL、投与速度125mL/時。
2). 体重80kg以上:
①. 1サイクル目:
a. 1日目:投与量350mg/250mL、投与速度(投与開始時)50mL/時、投与速度(投与開始2時間後)75mL/時。
b. 2日目:投与量1400mg/250mL、投与速度(投与開始時)25mL/時、投与速度(投与開始2時間後)50mL/時。
c. 8日目:投与量1750mg/250mL、投与速度65mL/時。
d. 15日目:投与量1750mg/250mL、投与速度85mL/時。
②. 2サイクル目:1日目:投与量1750mg/250mL、投与速度125mL/時。
③. 3サイクル目以降:1日目:投与量2100mg/250mL、投与速度125mL/時。
Infusion reactionが認められない場合は、投与開始2時間後に投与速度を上げることができる。
[本剤の投与量及び投与速度(ラゼルチニブとの併用の場合)]
1). 体重80kg未満:
①. 1サイクル目:
a. 1日目:投与量350mg/250mL、投与速度(投与開始時)50mL/時、投与速度(投与開始2時間後)75mL/時。
b. 2日目:投与量700mg/250mL、投与速度(投与開始時)50mL/時、投与速度(投与開始2時間後)75mL/時。
c. 8日目:投与量1050mg/250mL、投与速度85mL/時。
d. 15日目、22日目:投与量1050mg/250mL、投与速度125mL/時。
②. 2サイクル目以降:1日目、15日目:投与量1050mg/250mL、投与速度125mL/時。
2). 体重80kg以上:
①. 1サイクル目:
a. 1日目:投与量350mg/250mL、投与速度(投与開始時)50mL/時、投与速度(投与開始2時間後)75mL/時。
b. 2日目:投与量1050mg/250mL、投与速度(投与開始時)35mL/時、投与速度(投与開始2時間後)50mL/時。
c. 8日目:投与量1400mg/250mL、投与速度65mL/時。
d. 15日目:投与量1400mg/250mL、投与速度85mL/時。
e. 22日目:投与量1400mg/250mL、投与速度125mL/時。
②. 2サイクル目以降:1日目、15日目:投与量1400mg/250mL、投与速度125mL/時。
Infusion reactionが認められない場合は、投与開始2時間後に投与速度を上げることができる。
7.3. ラゼルチニブとの併用投与による静脈血栓塞栓症の発症を抑制するため、当該併用投与開始後4ヵ月間は、アピキサバン1回2.5mgを1日2回経口投与すること〔1.4、8.3、9.1.2、11.1.4参照〕。
7.4. 本剤投与により副作用が発現した場合には、次を参考に本剤を減量、中断、休薬又は中止すること。
[副作用発現時に本剤を減量する場合の投与量]
1). 副作用発現時の投与量1050mg:1段階減量700mg、2段階減量350mg、3段階減量は中止。
2). 副作用発現時の投与量1400mg:1段階減量1050mg、2段階減量700mg、3段階減量は中止。
3). 副作用発現時の投与量1750mg:1段階減量1400mg、2段階減量1050mg、3段階減量は中止。
4). 副作用発現時の投与量2100mg:1段階減量1750mg、2段階減量1400mg、3段階減量は中止。
[副作用発現時の本剤の処置]
1). Infusion reaction:
①. Grade1のInfusion reaction及びGrade2のInfusion reaction:a.投与を中断する、b.症状が回復した場合、発現時の50%の投与速度で再開する、c.再開後の30分間にinfusion reactionの症状が認められない場合、中断時の投与速度まで上げることができる(その後の2時間にinfusion reactionの症状が認められない場合、同日に予定されていた最高速度まで上げることができる)。d.Grade2のinfusion reactionによる投与中断・再開後にGrade2のinfusion reactionが再発した場合、同日における投与は中止を検討する。
②. Grade3のInfusion reaction:a.同日における投与を中止する、b.次回以降の投与可否は患者の状態に応じて判断し、投与速度はGrade2の場合を参考に患者の状態に応じて判断する、c.Grade3のinfusion reactionが再発した場合、投与を中止する。
③. Grade4のInfusion reaction:投与を中止する。
2). 間質性肺疾患:
①. 間質性肺疾患疑い:休薬する。
②. 間質性肺疾患確定:投与を中止する。
3). 静脈血栓塞栓症(ラゼルチニブとの併用時):
①. 静脈血栓塞栓症(ラゼルチニブとの併用時):臨床的に不安定な事象が発現した場合(例:呼吸不全、心機能障害)、発現した事象が臨床的に安定するまで休薬する。
②. 静脈血栓塞栓症(ラゼルチニブとの併用時):抗凝固剤による治療中に静脈血栓塞栓症再発した場合、投与を中止する。
4). 皮膚障害又は爪障害:
①. Grade1の皮膚障害又はGrade1の爪障害:2週間後に改善が認められない場合、減量を検討する。
②. Grade2の皮膚障害又はGrade2の爪障害:a.ラゼルチニブとの併用時は、減量を検討する、Grade2の皮膚障害又はGrade2の爪障害:b.2週間後に改善が認められない場合、減量を検討する。
③. Grade3の皮膚障害又はGrade3の爪障害:a.Grade2以下に回復するまで休薬し、減量して投与を再開する、Grade3の皮膚障害又はGrade3の爪障害:b.ラゼルチニブとの併用時は休薬し、週1回の観察を行う(2週間以内にGrade2以下に回復した場合は減量を検討した上で投与を再開し、2週間以内にGrade2以下に回復しない場合は投与を中止する)。
④. Grade4の皮膚障害又はGrade4の爪障害、重度水疱性皮膚障害又は重度剥脱性皮膚障害:投与を中止する。
5). その他の副作用:
①. Grade2の副作用:a.休薬を検討する(1週間より後に改善した場合、減量して投与を再開することを検討する)、Grade2の副作用:b.ラゼルチニブとの併用時は、休薬又は減量を検討する(28日以内に改善した場合は同じ用量又は減量して投与を再開することを検討し、28日より後に改善した場合は減量して投与を再開することを検討する)。
②. Grade3の副作用:a.Grade1以下又はベースラインに回復するまで休薬する、b.1週間以内に回復した場合、同じ用量で投与を再開する、c.1週間より後に回復した場合、減量して投与を再開する、d.4週間以内に回復しない場合、投与の中止を検討する。
③. Grade4の副作用:原則として投与を中止する。
GradeはNCI-CTCAE v5.0に準じる。
7.5. EGFR-TKI治療歴のないエクソン20挿入変異を除くEGFR変異陽性の切除不能な進行・再発の非小細胞肺癌に対するA法の有効性及び安全性は確立していない(EGFR-TKI:EGFRチロシンキナーゼ阻害剤)。
7.6. 本剤、ラゼルチニブ、カルボプラチン及びペメトレキセドナトリウムの併用投与は行わないこと。
改訂情報
2025年7月8日 DSU No.337 【その他】
【5.効能又は効果に関連する注意】(追記)
〈EGFR遺伝子変異陽性の切除不能な進行・再発の非小細胞肺癌〉
EGFRチロシンキナーゼ阻害剤による治療後に増悪した患者に対してカルボプラチン及びペメトレキセドナトリウムと併用する場合は、臨床試験に組み入れられた患者の前治療歴等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
【6.用法及び用量】(一部改訂)
EGFR遺伝子エクソン20挿入変異陽性の切除不能な進行・再発の非小細胞肺癌にはA法、EGFR遺伝子変異(エクソン20挿入変異を除く)陽性の切除不能な進行・再発の非小細胞肺癌にはA法又はB法を使用する。
A法:カルボプラチン及びペメトレキセドナトリウムとの併用において、3週間を1サイクルとし、通常、成人にはアミバンタマブ(遺伝子組換え)として以下の用法及び用量で点滴静注する。なお、患者の状態により適宜減量する。
B法:ラゼルチニブメシル酸塩との併用において、4週間を1サイクルとし、通常、成人にはアミバンタマブ(遺伝子組換え)として以下の用法及び用量で点滴静注する。なお、患者の状態により適宜減量する。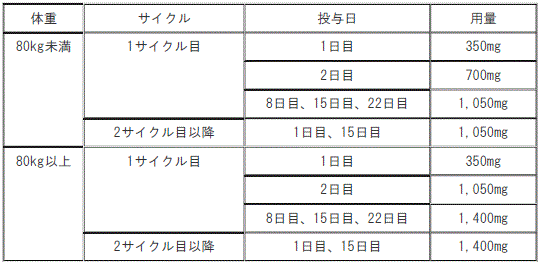
【7.用法及び用量に関連する注意】(追記)
EGFRチロシンキナーゼ阻害剤による治療歴のないEGFR遺伝子変異(エクソン20挿入変異を除く)陽性の切除不能な進行・再発の非小細胞肺癌に対するA法の有効性及び安全性は確立していない。
【7.用法及び用量に関連する注意】(追記)
本剤、ラゼルチニブ、カルボプラチン及びペメトレキセドナトリウムの併用投与は行わないこと。
【14.適用上の注意】(一部改訂)
[薬剤投与時の注意]
輸液ポンプ及び投与セットを用いて、点滴静注により調製後の本剤を投与する。また、投与セットは、滅菌されたパイロジェンフリー(エンドトキシンフリー)の低蛋白結合性のポリエーテルスルホン製、ナイロン製又はポリスルホン製のインラインフィルター(孔径0.2μm又は0.22μm)を備えたポリウレタン、ポリブタジエン、ポリ塩化ビニル、ポリプロピレン又はポリエチレン製を用いること。
【14.適用上の注意】(一部改訂)
調製後の本剤は、室内光下にて室温のもと、溶液の調製開始後10時間以内に投与を完了すること。
2025年4月22日 DSU No.335 【その他】
【1.警告】(追記)
ラゼルチニブとの併用投与により、深部静脈血栓症及び肺塞栓症を含む静脈血栓塞栓症があらわれ、死亡に至った症例が報告されているので、静脈血栓塞栓症の既往歴の有無等を確認した上で、投与の可否を慎重に判断すること。また、本剤投与中は患者の状態を十分に観察し、下肢の疼痛・浮腫、突然の呼吸困難、息切れ、胸痛等の静脈血栓塞栓症が疑われる徴候や症状の発現に注意すること。
【5.効能又は効果に関連する注意】(追記)
〈EGFR遺伝子変異陽性の切除不能な進行・再発の非小細胞肺癌〉
十分な経験を有する病理医又は検査施設における検査により、EGFR遺伝子変異(エクソン20挿入変異を除く)が確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器注)を用いること。
注)承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
【5.効能又は効果に関連する注意】(追記)
本剤の術前・術後補助療法としての有効性及び安全性は確立していない。
【6.用法及び用量】(追記)
〈EGFR遺伝子変異陽性の切除不能な進行・再発の非小細胞肺癌〉
ラゼルチニブメシル酸塩との併用において、4週間を1サイクルとし、通常、成人にはアミバンタマブ(遺伝子組換え)として以下の用法及び用量で点滴静注する。なお、患者の状態により適宜減量する。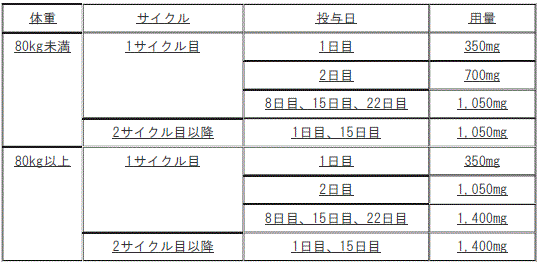
【7.用法及び用量に関連する注意】(追記)
調製後の希釈液を以下の速度で投与すること。
本剤の投与量及び投与速度(ラゼルチニブとの併用の場合)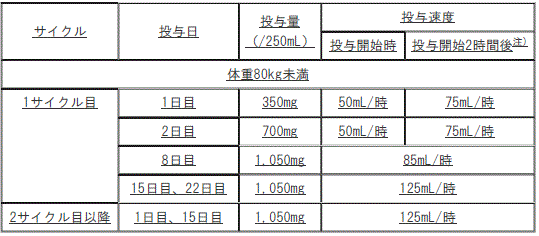
【7.用法及び用量に関連する注意】(追記)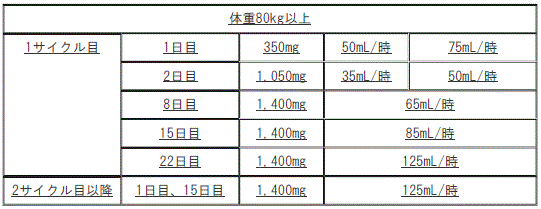
【7.用法及び用量に関連する注意】(追記)
注)Infusion reactionが認められない場合は、投与開始2時間後に投与速度を上げることができる。
【7.用法及び用量に関連する注意】(追記)
ラゼルチニブとの併用投与による静脈血栓塞栓症の発症を抑制するため、当該併用投与開始後4カ月間は、アピキサバン1回2.5mgを1日2回経口投与すること。
【7.用法及び用量に関連する注意】(追記)
本剤投与により副作用が発現した場合には、以下の表を参考に本剤を減量、中断、休薬又は中止すること。
副作用発現時の本剤の処置
静脈血栓塞栓症(ラゼルチニブとの併用時)
【7.用法及び用量に関連する注意】(一部改訂)
皮膚障害又は爪障害
【7.用法及び用量に関連する注意】(一部改訂)
その他の副作用
【7.用法及び用量に関連する注意】(一部改訂)
※GradeはNCI-CTCAE v5.0に準じる。
【8.重要な基本的注意】(追記)
ラゼルチニブとの併用により静脈血栓塞栓症の発現頻度が増加する傾向が認められているので、初期症状(下肢の疼痛・浮腫、突然の呼吸困難、息切れ、胸痛等)の確認及び定期的な凝固能検査の実施等、観察を十分に行うこと。また、患者に対して、初期症状があらわれた場合には、速やかに医療機関を受診するよう指導すること。
【9.1合併症・既往歴等のある患者】(追記)
静脈血栓塞栓症のある患者又はその既往歴のある患者:
静脈血栓塞栓症が悪化又は再発するおそれがある。
【9.8高齢者】(新設)
ラゼルチニブとの併用投与については、投与の可否を慎重に判断すること。本剤とラゼルチニブを併用した臨床試験において、65歳未満の患者と比較して65歳以上の患者で死亡に至った有害事象、重篤な有害事象及び投与中止に至った有害事象の発現割合が高い傾向が認められている。
【11.1重大な副作用】(追記)
動脈血栓塞栓症:
本剤とラゼルチニブとの併用において、心筋梗塞等の動脈血栓塞栓症があらわれることがある。
【11.2その他の副作用】(一部改訂)
医師の処方により使用する医薬品。
特定薬剤管理指導加算等の算定対象となる薬剤。



 で医薬品を比較する
で医薬品を比較する
