ゾフルーザ顆粒2%分包
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
医薬品コード(YJコード):6250047D1021
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- バロキサビル マルボキシル顆粒
- 英名(商品名)
- Xofluza
- 規格
- 2%500mg1包
- 薬価
- 1,666.20
- メーカー名
- 塩野義製薬
- 規制区分
- -
- 長期投与制限
- -
- 標榜薬効
- 抗インフルエンザウイルス薬〔キャップ依存性エンドヌクレアーゼ阻害薬〕
- 色
- 白〜淡黄白
- 識別コード
- -
- [@: メーカーロゴ]
- 添付文書
-
PDF 2025年9月改訂(第6版)
- 告示日
- 2025年11月11日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2025年12月版
- 医薬品マスタ削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
A型インフルエンザウイルス感染症又はB型インフルエンザウイルス感染症の治療及びその予防。
(効能又は効果に関連する注意)
5.1. 〈効能共通〉本剤は細菌感染症には効果がない〔1.1、8.2参照〕。
5.2. 〈効能共通〉小児に対する投与については、低年齢になるほど低感受性株の出現頻度が高くなる傾向が示されていることから、学会等から提唱されている最新のガイドライン等を参照し、慎重に検討すること〔1.2、5.4、5.6、18.3.1参照〕。
5.3. 〈治療〉抗ウイルス薬の投与がA型又はB型インフルエンザウイルス感染症の全ての患者に対しては必須ではないことを踏まえ、本剤の投与の必要性を慎重に検討すること〔1.1参照〕。
5.4. 〈治療〉体重20kg未満の小児に対する投与については、他の抗インフルエンザウイルス薬の使用を考慮した上で、本剤の投与の必要性を特に慎重に検討すること〔1.2、5.2、18.3.1参照〕。
5.5. 〈予防〉原則として、インフルエンザウイルス感染症を発症している患者の同居家族又は共同生活者で、インフルエンザウイルス感染症罹患時に重症化のリスクが高いと判断される者(高齢者(65歳以上)、慢性呼吸器疾患又は慢性心疾患患者、代謝性疾患患者(糖尿病等)等)を対象とする〔1.1参照〕。
5.6. 〈予防〉小児に対する投与については、流行ウイルスの薬剤耐性情報に留意し、他の抗インフルエンザウイルス薬の使用を考慮した上で、慎重に検討すること〔5.2、18.3.1参照〕。
5.7. 〈予防〉本剤のB型インフルエンザウイルス感染症に対する予防投与について、有効性を示すデータは限られていることを考慮した上で、本剤の投与を慎重に検討すること〔17.1.5参照〕。
用法用量
通常、次の用量を単回経口投与する。
1). 治療
①. 成人及び12歳以上の小児(体重80kg以上):顆粒8包(バロキサビル マルボキシルとして80mg)。
②. 成人及び12歳以上の小児(体重80kg未満):顆粒4包(バロキサビル マルボキシルとして40mg)。
③. 12歳未満の小児(体重40kg以上):顆粒4包(バロキサビル マルボキシルとして40mg)。
④. 12歳未満の小児(体重20kg以上40kg未満):顆粒2包(バロキサビル マルボキシルとして20mg)。
⑤. 12歳未満の小児(体重10kg以上20kg未満):顆粒1包(バロキサビル マルボキシルとして10mg)。
⑥. 12歳未満の小児(体重10kg未満):顆粒50mg/kg(バロキサビル マルボキシルとして1mg/kg)。
2). 予防
①. 成人及び12歳以上の小児(体重80kg以上):顆粒8包(バロキサビル マルボキシルとして80mg)。
②. 成人及び12歳以上の小児(体重80kg未満):顆粒4包(バロキサビル マルボキシルとして40mg)。
③. 12歳未満の小児(体重40kg以上):顆粒4包(バロキサビル マルボキシルとして40mg)。
④. 12歳未満の小児(体重20kg以上40kg未満):顆粒2包(バロキサビル マルボキシルとして20mg)。
(用法及び用量に関連する注意)
7.1. 〈効能共通〉10mg錠と20mg錠の生物学的同等性は示されていないため、20mg以上の用量を投与する際には、10mg錠を使用しないこと。
7.2. 〈治療〉本剤の投与は、症状発現後、可能な限り速やかに開始することが望ましい(症状発現から48時間経過後に投与を開始した患者における有効性を裏付けるデータは得られていない)。
7.3. 〈予防〉インフルエンザウイルス感染症患者に接触後2日以内に投与を開始すること(接触後48時間経過後に投与を開始した場合における有効性を裏付けるデータは得られていない)〔17.1.5参照〕。
7.4. 〈予防〉本剤を服用した日から10日を超えた期間のインフルエンザウイルス感染症に対する予防効果は確認されていない〔17.1.5参照〕。
改訂情報
2025年11月5日 DSU No.340 【その他】
【1.警告】(追記)
〈治療〉
抗ウイルス薬の投与がA型又はB型インフルエンザウイルス感染症の全ての患者に対しては必須ではないことに加え、低年齢になるほど低感受性株の出現頻度が高くなる傾向が示されており、本剤の投与が拡大した場合に、低感受性株が地域社会に伝播拡大する可能性が否定できないことを踏まえ、体重20kg未満の小児に対しては、他の抗インフルエンザウイルス薬の使用を考慮した上で、本剤の投与の必要性を特に慎重に検討すること。
【5.効能又は効果に関連する注意】(追記)
〈治療〉
体重20kg未満の小児に対する投与については、他の抗インフルエンザウイルス薬の使用を考慮した上で、本剤の投与の必要性を特に慎重に検討すること。
【6.用法及び用量】(一部改訂)
通常、以下の用量を単回経口投与する。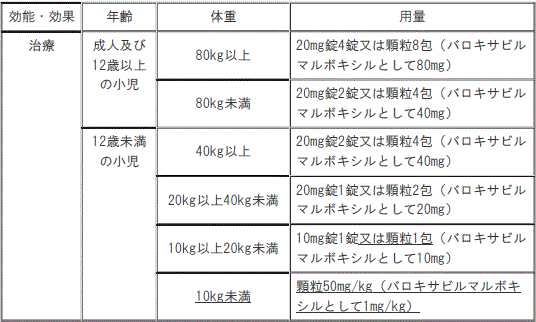
【7.用法及び用量に関連する注意】(一部改訂)
〈効能共通〉
10mg錠と20mg錠の生物学的同等性は示されていないため、20mg以上の用量を投与する際には、10mg錠を使用しないこと。
【9.7小児等】(一部改訂)
〈製剤共通〉
低出生体重児又は新生児を対象とした臨床試験は実施していない。
【9.7小児等】(追記)
新生児や乳児ではビタミンK欠乏をきたすおそれがあり、本剤投与により出血傾向が発現するおそれがあるため、本剤投与前に国内ガイドラインに基づきビタミンK製剤が投与されていることを確認すること。ビタミンKの不足が予想される場合はビタミンK製剤をあらかじめ投与すること。また、患者の家族に対して、患者の状態を慎重に確認し、出血や意識障害等が認められた場合には医師に連絡するよう指導すること。
医師の処方により使用する医薬品。



 で医薬品を比較する
で医薬品を比較する
