タグリッソ錠40mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- オシメルチニブメシル酸塩錠
- 英名(商品名)
- Tagrisso
- 規格
- 40mg1錠
- 薬価
- 9,670.00
- メーカー名
- アストラゼネカ
- 規制区分
- 劇薬
- 長期投与制限
- -
- 標榜薬効
- 抗悪性腫瘍薬〔チロシンキナーゼ阻害薬〕
- 色
- 明帯灰黄赤
- 識別コード
- (本体)AZ 40 (被包)@ (被包)AZ
- [@: メーカーロゴ]
- 添付文書
-
PDF 2025年5月改訂(第7版)
- 告示日
- 2016年5月24日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2016年6月版
- 医薬品マスタ削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
1). EGFR遺伝子変異陽性の手術不能又は再発非小細胞肺癌。
2). EGFR遺伝子変異陽性の非小細胞肺癌における術後補助療法。
3). EGFR遺伝子変異陽性の切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法。
(効能又は効果に関連する注意)
5.1. 〈効能共通〉EGFR遺伝子変異検査を実施すること。EGFR遺伝子変異検査の実施には、十分な経験を有する病理医又は検査施設において、承認された体外診断用医薬品又は医療機器を用い、EGFR遺伝子変異が確認された患者に投与すること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、次のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html。
5.2. 〈効能共通〉「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.1-17.1.5参照〕。
5.3. 〈効能共通〉本剤の術前補助療法における有効性及び安全性は確立していない。
5.4. 〈EGFR遺伝子変異陽性の手術不能又は再発非小細胞肺癌〉他のEGFRチロシンキナーゼ阻害剤による治療歴を有し、病勢進行が確認されている患者では、EGFR T790M変異が確認された患者に投与すること。
5.5. 〈EGFR遺伝子変異陽性の非小細胞肺癌における術後補助療法〉白金系抗悪性腫瘍剤を含む術後補助療法の適応となる場合には、当該治療を終了した患者を対象とすること。
5.6. 〈EGFR遺伝子変異陽性の非小細胞肺癌における術後補助療法〉EGFR遺伝子変異陽性の非小細胞肺癌における術後補助療法で病理病期1B期(AJCC/UICC 第7版)の患者に対する有効性及び安全性は確立していない。
5.7. 〈EGFR遺伝子変異陽性の切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法〉根治的化学放射線療法後に病勢進行が認められていない患者を対象とすること。
用法用量
通常、成人にはオシメルチニブとして80mgを1日1回経口投与する。ただし、術後補助療法の場合は、投与期間は36カ月間までとする。なお、患者の状態により適宜減量する。
(用法及び用量に関連する注意)
7.1. 〈効能共通〉副作用がみられた場合は、症状、重症度等に応じて、次の基準を考慮して、本剤を休薬、減量又は中止すること。本剤を減量する場合には、40mgを1日1回投与すること。
[本剤の休薬、減量及び中止基準の目安]
1). 〈効能共通〉間質性肺疾患/肺臓炎:本剤の投与を中止する。
2). 〈効能共通〉放射線肺臓炎:
①. 〈効能共通〉Grade1の放射線肺臓炎;患者の状態に応じて、本剤の投与を継続又は休薬する。
②. 〈効能共通〉Grade2の放射線肺臓炎;Grade1以下に回復するまで本剤を休薬し、4週間以内にGrade1以下に回復した場合、必要に応じて本剤の減量を考慮し、投与を再開する(4週間以内にGrade1以下に回復しない場合及び再開後に再発した場合は、本剤の投与を中止する)。
③. 〈効能共通〉Grade3以上の放射線肺臓炎;本剤の投与を中止する。
3). 〈効能共通〉QT間隔延長:
①. 〈効能共通〉500msecを超えるQTc値が認められる;481msec未満又はベースラインに回復するまで本剤を休薬し、481msec未満又はベースラインに回復した後、本剤を減量し、投与を再開する(3週間以内に回復しない場合は本剤の投与を中止すること)。
②. 〈効能共通〉重篤な不整脈の症状を伴うQT間隔延長/重篤な不整脈の兆候を伴うQT間隔延長;本剤の投与を中止する。
4). 〈効能共通〉その他の副作用:Grade3以上の副作用;Grade2以下に改善するまで本剤を休薬し、Grade2以下に回復した後、必要に応じて本剤の減量を考慮し、投与を再開する(3週間以内にGrade2以下に回復しない場合は本剤の投与を中止すること)。
GradeはCTCAE(Common Terminology Criteria for Adverse Events)ver.4.0に基づく。
7.2. 〈EGFR遺伝子変異陽性の手術不能又は再発非小細胞肺癌〉本剤を他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤は「17.臨床成績」の項の内容を熟知し選択すること〔17.1.4参照〕。
7.3. 〈EGFR遺伝子変異陽性の非小細胞肺癌における術後補助療法、EGFR遺伝子変異陽性の切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法〉他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
外形画像


改訂情報
2025年7月8日 DSU No.337 【その他】
【5.効能又は効果に関連する注意】(追記)
〈効能共通〉
本剤の術前補助療法における有効性及び安全性は確立していない。
【5.効能又は効果に関連する注意】(追記)
〈EGFR遺伝子変異陽性の切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法〉
根治的化学放射線療法後に病勢進行が認められていない患者を対象とすること。
【7.用法及び用量に関連する注意】(追記)
〈効能共通〉
副作用がみられた場合は、症状、重症度等に応じて、以下の基準を考慮して、本剤を休薬、減量又は中止すること。本剤を減量する場合には、40mgを1日1回投与すること。
本剤の休薬、減量及び中止基準の目安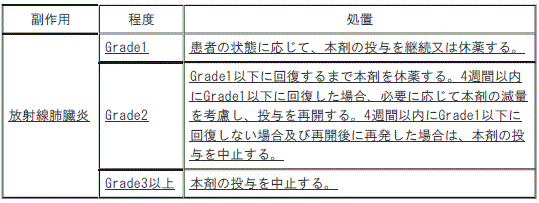
【7.用法及び用量に関連する注意】(追記)
〈EGFR遺伝子変異陽性の非小細胞肺癌における術後補助療法、EGFR遺伝子変異陽性の切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法〉
他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
【8.重要な基本的注意】(一部改訂)
間質性肺疾患、放射線肺臓炎があらわれることがあるので、初期症状(呼吸困難、咳嗽、発熱等)の確認及び定期的な胸部画像検査の実施等、観察を十分に行うこと。必要に応じて、動脈血酸素分圧(PaO2)、動脈血酸素飽和度(SpO2)、肺胞気動脈血酸素分圧較差(A-aDO2)、肺拡散能力(DLco)等の検査を行うこと。また、患者に対して、初期症状があらわれた場合には、速やかに医療機関を受診するよう指導すること。
【9.1合併症・既往歴等のある患者】(追記)
放射線肺臓炎のある患者:
臨床試験では、化学放射線療法後の症候性放射線肺臓炎は除外されていた。
【11.1重大な副作用】(一部改訂)
間質性肺疾患、放射線肺臓炎:
異常が認められた場合には投与中止、ステロイド治療等の適切な処置を行うこと。
よく一緒に見られている薬
医師の処方により使用する医薬品。
特定薬剤管理指導加算等の算定対象となる薬剤。



 で医薬品を比較する
で医薬品を比較する
