ハイキュービア10%皮下注セット10g/100mL
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
医薬品コード(YJコード):6343501A2021
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- pH4処理酸性人免疫グロブリン(皮下注射)・ボルヒアルロニダーゼ アルファ(遺伝子組換え)注射液
- 英名(商品名)
- HyQvia
- 規格
- 1セット
- 薬価
- 112,154.00
- メーカー名
- 武田薬品
- 規制区分
- -
- 長期投与制限
- 14日(2026年05月末まで)
- 標榜薬効
- ヒト免疫グロブリン
- 色
- -
- 識別コード
- -
- [@: メーカーロゴ]
- 添付文書
-
PDF 2025年6月改訂(第3版)
- 告示日
- 2025年5月20日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2025年6月版
- 医薬品マスタ削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
1). 無ガンマグロブリン血症又は低ガンマグロブリン血症。
2). 慢性炎症性脱髄性多発根神経炎及び多巣性運動ニューロパチーの運動機能低下の進行抑制(筋力低下の改善が認められた場合)。
(効能又は効果に関連する注意)
〈慢性炎症性脱髄性多発根神経炎及び多巣性運動ニューロパチーの運動機能低下の進行抑制〉慢性炎症性脱髄性多発根神経炎及び多巣性運動ニューロパチーの患者に対して静注用人免疫グロブリン製剤を投与し筋力低下の改善が認められたものの、症状の再発・再燃を繰り返している患者にのみ投与すること。
用法用量
〈無又は低ガンマグロブリン血症〉
ボルヒアルロニダーゼ アルファ(遺伝子組換え)を皮下投与した後、約10分以内に同じ部位へ人免疫グロブリンGを皮下投与する。
人免疫グロブリンG及びボルヒアルロニダーゼ アルファ(遺伝子組換え)の投与は、次の用量の1/3又は1/4から開始し、漸増する。また、投与間隔は投与量に併せて延長する。
・ 通常、人免疫グロブリンGとして150~600mg(1.5~6mL)/kg体重を3週間に1回又は200~800mg(2~8mL)/kg体重を4週間に1回投与する。
・ ボルヒアルロニダーゼ アルファ(遺伝子組換え)は、人免疫グロブリンG1gあたり80単位(0.5mL)を投与する。
なお、患者の状態に応じて、3週又は4週あたりの投与量及び投与回数は適宜増減する。
〈慢性炎症性脱髄性多発根神経炎及び多巣性運動ニューロパチーの運動機能低下の進行抑制(筋力低下の改善が認められた場合)〉
通常、成人には、ボルヒアルロニダーゼ アルファ(遺伝子組換え)を皮下投与した後、約10分以内に同じ部位へ人免疫グロブリンGを皮下投与する。
人免疫グロブリンG及びボルヒアルロニダーゼ アルファ(遺伝子組換え)は、次の用法及び用量で皮下投与するが、原則として開始用量は、次の用量の1/3又は1/4とし、投与量に併せて投与間隔を延長しながら漸増すること。
・ 人免疫グロブリンGとして1.0g(10mL)/kg体重を3週間に1回投与するが、患者の状態に応じて、0.3~1.6g(3~16mL)/kg体重を3週間に1回、又は0.4~2.2g(4~22mL)/kg体重を4週間に1回の範囲で適宜増減する。
・ ボルヒアルロニダーゼ アルファ(遺伝子組換え)は、人免疫グロブリンG1gあたり80単位(0.5mL)を投与する。
なお、1回あたりの人免疫グロブリンGの投与量及び忍容性に応じて、人免疫グロブリンG及びボルヒアルロニダーゼ アルファ(遺伝子組換え)を48~72時間間隔で分割して投与することができる。
(用法及び用量に関連する注意)
7.1. 〈効能共通〉皮下注射にのみ使用すること。静脈内に投与してはならない。
7.2. 〈効能共通〉必ずボルヒアルロニダーゼ アルファ(遺伝子組換え)注射液から先に注入すること。ボルヒアルロニダーゼ アルファ(遺伝子組換え)注射液と人免疫グロブリン注射液を混合しないこと〔14.1.3参照〕。
7.3. 〈効能共通〉注入部位漏出が人免疫グロブリン注射液投与中又は投与後に生じる可能性があるため、患者の状態に応じて、複数の注入部位への投与及び投与速度の減速を検討すること。複数の部位へ投与する場合、各部位の投与量は同等となるように総投与量を部位数で割って算出すること〔14.2.3-14.2.5参照〕。
7.4. 〈無又は低ガンマグロブリン血症〉忍容性確保のため、本剤の投与時期及び投与量は次の用量漸増法を参考にし、投与量の漸増に伴い、投与間隔も延長すること(なお、本剤の投与量は、感染頻度や重症度等の本剤による治療の臨床反応及び血清IgG濃度を参考に調節すること)。
[目標投与量(投与量漸増後の用量)を3週間間隔で投与する場合の用量漸増法]
1). (投与回数)初回、(投与時期)1週目:目標投与量の1/3。
2). (投与回数)2回目、(投与時期)2週目:目標投与量の2/3。
3). (投与回数)3回目及び以後の投与、(投与時期)4週目及び以後3週間間隔:目標投与量。
[目標投与量(投与量漸増後の用量)を4週間間隔で投与する場合の用量漸増法]
1). (投与回数)初回、(投与時期)1週目:目標投与量の1/4。
2). (投与回数)2回目、(投与時期)2週目:目標投与量の1/2。
3). (投与回数)3回目、(投与時期)4週目:目標投与量の3/4。
4). (投与回数)4回目及び以後の投与、(投与時期)7週目及び以後4週間間隔:目標投与量。
7.4.1. 〈無又は低ガンマグロブリン血症〉静注用人免疫グロブリン製剤から本剤に切り換える患者では、本剤の初回投与は、静注用人免疫グロブリン製剤の最終投与から約1週間後とし、初回の人免疫グロブリン注射液の投与量は切換え前の静注用人免疫グロブリン製剤の1週あたりの投与量と同量とすること(漸増後の投与間隔は切換え前の静注用人免疫グロブリン製剤の投与間隔と同様とするが、患者の臨床反応に応じて変更も可能である)。
7.4.2. 〈無又は低ガンマグロブリン血症〉他の皮下注用人免疫グロブリン製剤から本剤に切り換える患者では、本剤の初回投与は他の皮下注用人免疫グロブリン製剤を週1回投与していた患者では他の皮下注用人免疫グロブリン製剤の最終投与から1週間後、他の皮下注用人免疫グロブリン製剤を2週に1回投与していた患者では他の皮下注用人免疫グロブリン製剤の最終投与から2週間後とすること(初回の人免疫グロブリン注射液の投与量は切換え前の他の皮下注用人免疫グロブリン製剤の1週あたりの投与量と同量とし、漸増後の投与間隔は3週間又は4週間間隔に調整すること)。
7.4.3. 〈無又は低ガンマグロブリン血症〉人免疫グロブリン製剤による治療歴のない患者を対象とした本剤の臨床試験は実施されていない。無ガンマグロブリン血症で人免疫グロブリン製剤による治療歴のない又は低ガンマグロブリン血症で人免疫グロブリン製剤による治療歴のない患者に対して本剤による導入を行う場合は、感染頻度や重症度等の本剤による治療の臨床反応と血清IgG濃度を参考に、投与量を慎重に調節し、漸増後の投与間隔は3週間又は4週間間隔に調整すること。
7.5. 〈無又は低ガンマグロブリン血症〉1日に投与できる人免疫グロブリン注射液の最大投与容量は、1部位に投与する場合は、体重40kg以上の患者は600mL、体重40kg未満の患者は300mL、複数部位に投与する場合は、体重40kg以上の患者は1200mL、体重40kg未満の患者は600mLである〔14.2.4参照〕。
7.6. 〈慢性炎症性脱髄性多発根神経炎及び多巣性運動ニューロパチーの運動機能低下の進行抑制〉原則として、患者の忍容性を確保するため、本剤の投与時期及び投与量は次の用量漸増法を参考に、最初の2回の投与で忍容性に問題がないことを確認したうえで、目標投与量に達するまで投与量を徐々に漸増するとともに、投与間隔も延長すること。
[本剤の用量漸増法]
1). 目標投与量を3週間間隔で投与する場合:
①. (投与回数)初回、(投与時期)1週目:目標投与量の1/3。
②. (投与回数)2回目、(投与時期)2週目:目標投与量の1/3。
③. (投与回数)3回目、(投与時期)3週目:目標投与量の2/3。
④. (投与回数)4回目及び以後の投与、(投与時期)5週目及び以後3週間間隔:目標投与量。
2). 目標投与量を4週間間隔で投与する場合:
①. (投与回数)初回、(投与時期)1週目:目標投与量の1/4。
②. (投与回数)2回目、(投与時期)2週目:目標投与量の1/4。
③. (投与回数)3回目、(投与時期)3週目:目標投与量の1/2。
④. (投与回数)4回目、(投与時期)5週目:目標投与量の3/4。
⑤. (投与回数)5回目及び以後の投与、(投与時期)8週目及び以後4週間間隔:目標投与量。
7.7. 〈慢性炎症性脱髄性多発根神経炎及び多巣性運動ニューロパチーの運動機能低下の進行抑制〉本剤の用量及び投与間隔は、次を参考に調整することとし、患者の臨床反応に応じて適宜調整すること。
7.7.1. 〈慢性炎症性脱髄性多発根神経炎及び多巣性運動ニューロパチーの運動機能低下の進行抑制〉静注用人免疫グロブリン製剤の維持療法から本剤に切り換える患者では、初回投与は切換え前の静注用人免疫グロブリン製剤の最終投与から2週間後とし、人免疫グロブリン注射液の目標投与量は切換え前の静注用人免疫グロブリン製剤と同量とし、本剤の投与間隔は切換え前の静注用人免疫グロブリン製剤の投与間隔と同様とすること(切換え前の静注用人免疫グロブリン製剤の投与間隔が3又は4週間間隔ではない場合は、本剤の投与間隔は3又は4週間とし、1週間あたりの目標投与量は切換え前の静注用人免疫グロブリン製剤と同等とすること)。
7.7.2. 〈慢性炎症性脱髄性多発根神経炎及び多巣性運動ニューロパチーの運動機能低下の進行抑制〉既存の皮下注用人免疫グロブリン製剤の維持療法から本剤に切り換える患者では、初回用量は既存の皮下注用人免疫グロブリン製剤と同量とすること。
7.7.3. 〈慢性炎症性脱髄性多発根神経炎及び多巣性運動ニューロパチーの運動機能低下の進行抑制〉静注用人免疫グロブリン製剤の導入療法後に本剤を維持療法として初めて開始する患者では、通常、目標投与量及び投与間隔は、人免疫グロブリンGとして、1.0g/kg体重を3週間に1回投与すること。
7.8. 〈慢性炎症性脱髄性多発根神経炎及び多巣性運動ニューロパチーの運動機能低下の進行抑制〉1日に投与できる人免疫グロブリン注射液の最大投与容量は、1部位に投与する場合は、体重40kg以上の患者は600mL、体重40kg未満の患者は300mL、複数部位に投与する場合は、体重40kg以上の患者は1200mL、体重40kg未満の患者は600mLであるので、1日あたりの最大投与容量の上限を超える場合、又は忍容性が低い場合は、注入部位で人免疫グロブリン注射液が吸収されるように、48~72時間間隔で分割して投与する(分割して投与する場合においても、人免疫グロブリン注射液の投与前にボルヒアルロニダーゼ アルファ(遺伝子組換え)注射液を都度投与すること)〔14.2.4参照〕。
改訂情報
2025年8月13日 DSU No.338 【その他】
【5.効能又は効果に関連する注意】(新設)
〈慢性炎症性脱髄性多発根神経炎及び多巣性運動ニューロパチーの運動機能低下の進行抑制〉
慢性炎症性脱髄性多発根神経炎及び多巣性運動ニューロパチーの患者に対して静注用人免疫グロブリン製剤を投与し筋力低下の改善が認められたものの、症状の再発・再燃を繰り返している患者にのみ投与すること。
【6.用法及び用量】(追記)
〈慢性炎症性脱髄性多発根神経炎及び多巣性運動ニューロパチーの運動機能低下の進行抑制(筋力低下の改善が認められた場合)〉
通常、成人には、ボルヒアルロニダーゼアルファ(遺伝子組換え)を皮下投与した後、約10分以内に同じ部位へ人免疫グロブリンGを皮下投与する。
人免疫グロブリンG及びボルヒアルロニダーゼアルファ(遺伝子組換え)は、以下の用法及び用量で皮下投与するが、原則として開始用量は、以下の用量の1/3又は1/4とし、投与量に併せて投与間隔を延長しながら漸増すること。
・人免疫グロブリンGとして1.0g(10mL)/kg体重を3週間に1回投与するが、患者の状態に応じて、0.3~1.6g(3~16mL)/kg体重を3週間に1回、又は0.4~2.2g(4~22mL)/kg体重を4週間に1回の範囲で適宜増減する。
・ボルヒアルロニダーゼアルファ(遺伝子組換え)は、人免疫グロブリンG1gあたり80単位(0.5mL)を投与する。
なお、1回あたりの人免疫グロブリンGの投与量及び忍容性に応じて、人免疫グロブリンG及びボルヒアルロニダーゼアルファ(遺伝子組換え)を48~72時間間隔で分割して投与することができる。
【7.用法及び用量に関連する注意】(追記)
〈慢性炎症性脱髄性多発根神経炎及び多巣性運動ニューロパチーの運動機能低下の進行抑制〉
原則として、患者の忍容性を確保するため、本剤の投与時期及び投与量は下表の用量漸増法を参考に、最初の2回の投与で忍容性に問題がないことを確認したうえで、目標投与量に達するまで投与量を徐々に漸増するとともに、投与間隔も延長すること。
本剤の用量漸増法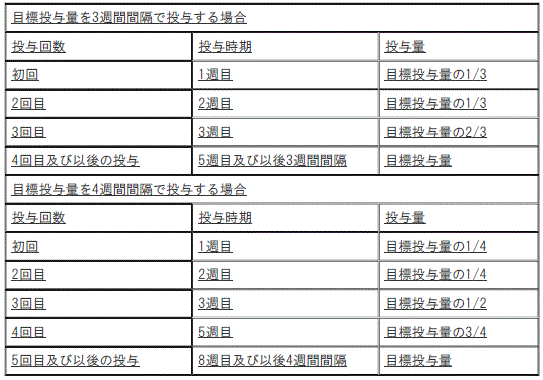
【7.用法及び用量に関連する注意】(追記)
本剤の用量及び投与間隔は、以下を参考に調整することとし、患者の臨床反応に応じて適宜調整すること。
1.静注用人免疫グロブリン製剤の維持療法から本剤に切り換える患者では、初回投与は切換え前の静注用人免疫グロブリン製剤の最終投与から2週間後とすること。人免疫グロブリン注射液の目標投与量は切換え前の静注用人免疫グロブリン製剤と同量とし、本剤の投与間隔は切換え前の静注用人免疫グロブリン製剤の投与間隔と同様とすること。切換え前の静注用人免疫グロブリン製剤の投与間隔が3又は4週間間隔ではない場合は、本剤の投与間隔は3又は4週間とし、1週間あたりの目標投与量は切換え前の静注用人免疫グロブリン製剤と同等とすること。
2.既存の皮下注用人免疫グロブリン製剤の維持療法から本剤に切り換える患者では、初回用量は既存の皮下注用人免疫グロブリン製剤と同量とすること。
3.静注用人免疫グロブリン製剤の導入療法後に本剤を維持療法として初めて開始する患者では、通常、目標投与量及び投与間隔は、人免疫グロブリンGとして、1.0g/kg体重を3週間に1回投与すること。
【7.用法及び用量に関連する注意】(追記)
1日に投与できる人免疫グロブリン注射液の最大投与容量は、1部位に投与する場合は、体重40kg以上の患者では600mL、体重40kg未満の患者では300mL、複数部位に投与する場合は、体重40kg以上の患者では1200mL、体重40kg未満の患者では600mLである。1日あたりの最大投与容量の上限を超える場合、又は忍容性が低い場合は、注入部位で人免疫グロブリン注射液が吸収されるように、48~72時間間隔で分割して投与する。分割して投与する場合においても、人免疫グロブリン注射液の投与前にボルヒアルロニダーゼアルファ(遺伝子組換え)注射液を都度投与すること。
【8.重要な基本的注意】(追記)
〈慢性炎症性脱髄性多発根神経炎及び多巣性運動ニューロパチーの運動機能低下の進行抑制〉
本剤による慢性炎症性脱髄性多発根神経炎及び多巣性運動ニューロパチーの治療は原因療法ではなく対症療法であることに留意すること。
【8.重要な基本的注意】(追記)
臨床症状の観察を十分に行い定期的に継続投与の必要性を確認すること。また、継続投与の結果十分な効果が認められず、運動機能低下の再発・再燃等を繰り返す場合には、本剤の継続投与は行わず、他の治療法を考慮すること。
【8.重要な基本的注意】(追記)
本剤を継続投与した結果、運動機能低下の再発・再燃が認められなくなった場合には、本剤の減量又は投与中止を考慮すること。
【9.7小児等】(追記)
〈慢性炎症性脱髄性多発根神経炎及び多巣性運動ニューロパチーの運動機能低下の進行抑制〉
18歳未満の患者を対象とした臨床試験は実施していない。
【10.2併用注意】(一部改訂)
【11.2その他の副作用】(一部改訂)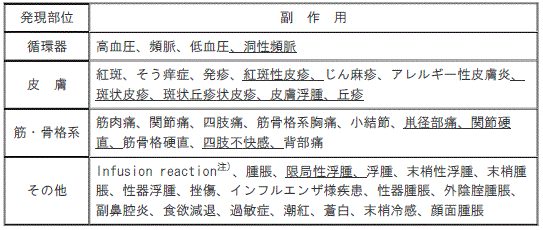
注)本剤投与中又は投与開始後短時間に発現した頭痛、疲労等
【15.1臨床使用に基づく情報】(一部改訂)
国内外臨床試験(9試験)において、11.9%(37/310例)に、ボルヒアルロニダーゼアルファ(遺伝子組換え)に対する結合抗体が認められた。結合抗体は、成人男性の精巣、精巣上体及び精子に発現することが知られている内因性ヒアルロニダーゼと交差反応を呈する可能性がある。結合抗体のヒトにおける臨床的意義は不明である。また、国内外臨床試験(9試験)において、ボルヒアルロニダーゼアルファ(遺伝子組換え)に対する中和抗体陽性が0.6%(2/310例)で検出されたが、中和抗体陽性に関連する有効性及び安全性の問題は認められなかった。
類似した薬効の薬
医師の処方により使用する医薬品。



 で医薬品を比較する
で医薬品を比較する
