テセントリク点滴静注840mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- アテゾリズマブ(遺伝子組換え)注射液
- 英名(商品名)
- Tecentriq
- 規格
- 840mg14mL1瓶
- 薬価
- 445,699.00
- メーカー名
- 中外製薬
- 規制区分
- 劇薬
- 長期投与制限
- -
- 標榜薬効
- 抗悪性腫瘍薬〔ヒト化抗ヒトPD−L1モノクローナル抗体〕
- 色
- -
- 識別コード
- -
- [@: メーカーロゴ]
- 添付文書
-
PDF 2025年11月改訂(第11版)
- 告示日
- 2019年11月26日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2019年12月版
- 医薬品マスタ削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
1). 切除不能な進行・再発の非小細胞肺癌。
2). PD-L1陽性の非小細胞肺癌における術後補助療法。
3). 進展型小細胞肺癌。
4). 切除不能な胞巣状軟部肉腫。
5). 再発又は難治性の節外性NK/T細胞リンパ腫・鼻型。
6). PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌。
(効能又は効果に関連する注意)
5.1. 〈切除不能な進行・再発の非小細胞肺癌〉化学療法未治療のPD-L1陰性の扁平上皮非小細胞肺癌患者における本剤の有効性及び安全性は確立していない。
5.2. 〈切除不能な進行・再発の非小細胞肺癌〉化学療法未治療の切除不能な進行・再発の非小細胞肺癌に対して本剤を単独で投与する場合には、腫瘍細胞・腫瘍浸潤免疫細胞におけるPD-L1発現率について「17.臨床成績」の項の内容を熟知し、十分な経験を有する病理医又は検査施設における検査により、PD-L1発現が確認された患者に投与する(検査には承認された体外診断用医薬品又は医療機器を用いる)。なお、承認された体外診断用医薬品又は医療機器に関する情報については、次のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html。
〔17.1.2参照〕。
5.3. 〈切除不能な進行・再発の非小細胞肺癌〉臨床試験に組み入れられた患者の前治療歴、EGFR遺伝子変異又はALK融合遺伝子の有無等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.1-17.1.5参照〕。
5.4. 〈PD-L1陽性の非小細胞肺癌における術後補助療法〉腫瘍細胞におけるPD-L1発現率について、「17.臨床成績」の項の内容を熟知し、十分な経験を有する病理医又は検査施設における検査により、PD-L1の発現が確認された患者に投与する(検査にあたっては、承認された体外診断用医薬品又は医療機器を用いる)。なお、承認された体外診断用医薬品又は医療機器に関する情報については、次のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html。
〔17.1.6参照〕。
5.5. 〈PD-L1陽性の非小細胞肺癌における術後補助療法〉臨床試験に組み入れられた患者の前治療歴、病期等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。また、PD-L1陽性の非小細胞肺癌における術後補助療法の場合、本剤の延命効果は、PD-L1発現率(TC)により異なる傾向が示唆されていることから、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.6参照〕。
5.6. 〈進展型小細胞肺癌〉臨床試験に組み入れられた患者の進展型の基準等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.7参照〕。
5.9. 〈PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌〉本剤の術前・術後薬物療法としての有効性及び安全性は確立していない。
5.10. 〈PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌〉PD-L1を発現した腫瘍浸潤免疫細胞の占める割合について、十分な経験を有する病理医又は検査施設における検査により、PD-L1の発現が確認された患者に投与すること(検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること)。なお、承認された体外診断用医薬品又は医療機器に関する情報については、次のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html。
HER2:Human Epidermal Growth Factor Receptor Type 2(ヒト上皮増殖因子受容体2型、別称:c-erbB-2)。
5.11. 〈再発又は難治性の節外性NK/T細胞リンパ腫・鼻型〉臨床試験に組み入れられた患者の前治療歴等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.12参照〕。
用法用量
〈効能共通〉
アテゾリズマブ(遺伝子組換え)の初回投与時は60分かけて点滴静注し、初回投与の忍容性が良好であれば、2回目以降の投与時間は30分間まで短縮できる。
1). 切除不能な進行・再発の非小細胞肺癌:
①. 化学療法未治療の扁平上皮癌を除く切除不能な進行・再発の非小細胞肺癌:他の抗悪性腫瘍剤との併用において、通常、成人にはアテゾリズマブ(遺伝子組換え)として1回1200mgを3週間間隔で点滴静注する。その後、単独投与する場合には、アテゾリズマブ(遺伝子組換え)として1回1200mgを3週間間隔又は1回1680mgを4週間間隔で点滴静注する。
②. 化学療法未治療のPD-L1陽性の切除不能な進行・再発の非小細胞肺癌:通常、成人にはアテゾリズマブ(遺伝子組換え)として1回1200mgを3週間間隔又は1回1680mgを4週間間隔で点滴静注する。
③. 化学療法既治療の切除不能な進行・再発の非小細胞肺癌:通常、成人にはアテゾリズマブ(遺伝子組換え)として1回1200mgを3週間間隔又は1回1680mgを4週間間隔で点滴静注する。
2). PD-L1陽性の非小細胞肺癌における術後補助療法:通常、成人にはアテゾリズマブ(遺伝子組換え)として1回1200mgを3週間間隔又は1回1680mgを4週間間隔で点滴静注する。PD-L1陽性の非小細胞肺癌における術後補助療法の場合、投与期間は12カ月間までとする。
3). 進展型小細胞肺癌:カルボプラチン及びエトポシドとの併用において、通常、成人にはアテゾリズマブ(遺伝子組換え)として1回1200mgを3週間間隔で4回点滴静注する。その後、アテゾリズマブ(遺伝子組換え)として1回1200mgを3週間間隔又は1回1680mgを4週間間隔で点滴静注する。
4). PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌:パクリタキセル(アルブミン懸濁型)との併用において、通常、成人にはアテゾリズマブ(遺伝子組換え)として1回840mgを2週間間隔又は1回1680mgを4週間間隔で点滴静注する。
5). 切除不能な胞巣状軟部肉腫:通常、成人にはアテゾリズマブ(遺伝子組換え)として1回1200mgを3週間間隔で点滴静注する。通常、2歳以上の小児にはアテゾリズマブ(遺伝子組換え)として1回15mg/kg(体重)(最大1200mg)を3週間間隔で点滴静注する。
6). 再発又は難治性の節外性NK/T細胞リンパ腫・鼻型:通常、成人にはアテゾリズマブ(遺伝子組換え)として1回1200mgを3週間間隔で点滴静注する。通常、12歳以上の小児にはアテゾリズマブ(遺伝子組換え)として1回15mg/kg(体重)(最大1200mg)を3週間間隔で点滴静注する。
(用法及び用量に関連する注意)
7.1. 〈効能共通〉本剤投与により副作用が発現した場合には、次の基準を目安に、本剤の休薬等を考慮すること。
1). 〈効能共通〉間質性肺疾患等の呼吸器障害:
①. 〈効能共通〉Grade2の間質性肺疾患等のGrade2の呼吸器障害の場合:Grade1以下に回復するまで、本剤を休薬する(12週間を超える休薬後もGrade1以下まで回復しない場合は、本剤を中止する)。
②. 〈効能共通〉Grade3以上の間質性肺疾患等のGrade3以上の呼吸器障害又は再発性間質性肺疾患等の再発性呼吸器障害の場合:本剤を中止する。
2). 〈効能共通〉肝機能障害:
①. 〈効能共通〉Grade2の肝機能障害が5日を超えて継続(ASTが基準値上限の3倍超かつ5倍以下の増加が5日を超えて継続若しくはALTが基準値上限の3倍超かつ5倍以下の増加が5日を超えて継続又は総ビリルビンが基準値上限の1.5倍超かつ3倍以下の増加が5日を超えて継続)する場合:Grade1以下に回復するまで、本剤を休薬する(12週間を超える休薬後もGrade1以下まで回復しない場合は、本剤を中止する)。
②. 〈効能共通〉Grade3以上の肝機能障害(ASTが基準値上限の5倍超若しくはALTが基準値上限の5倍超又は総ビリルビンが基準値上限の3倍超に増加)の場合:本剤を中止する。
3). 〈効能共通〉大腸炎/下痢:
①. 〈効能共通〉Grade2の大腸炎/Grade2の下痢又はGrade3の大腸炎/Grade3の下痢の場合:Grade1以下に回復するまで、本剤を休薬する(12週間を超える休薬後もGrade1以下まで回復しない場合は、本剤を中止する)。
②. 〈効能共通〉Grade4の大腸炎/Grade4の下痢の場合:本剤を中止する。
4). 〈効能共通〉膵炎:
①. 〈効能共通〉アミラーゼが基準値上限の2倍超又はリパーゼが基準値上限の2倍超に増加した場合、Grade2の膵炎又はGrade3の膵炎:Grade1以下に回復するまで、本剤を休薬する(12週間を超える休薬後もGrade1以下まで回復しない場合は、本剤を中止する)。
②. 〈効能共通〉Grade4の膵炎又は再発性膵炎:本剤を中止する。
5). 〈効能共通〉内分泌障害:
①. 〈効能共通〉空腹時血糖値が250mg/dL超:血糖値が安定するまで、本剤を休薬する。
②. 〈効能共通〉症候性甲状腺機能低下症、症候性甲状腺機能亢進症、又は甲状腺刺激ホルモン値0.1mU/L未満の無症候性甲状腺機能亢進症:前記の状態が回復するまで、本剤を休薬する。
③. 〈効能共通〉Grade2以上の副腎機能不全:Grade1以下に回復するまで、本剤を休薬する(12週間を超える休薬後もGrade1以下まで回復しない場合は、本剤を中止する)。
④. 〈効能共通〉Grade2の下垂体炎又はGrade3の下垂体炎、Grade2の下垂体機能低下症又はGrade3の下垂体機能低下症:Grade1以下に回復するまで、本剤を休薬する(12週間を超える休薬後もGrade1以下まで回復しない場合は、本剤を中止する)。
⑤. 〈効能共通〉Grade4の下垂体炎又は再発性下垂体炎、Grade4の下垂体機能低下症又は再発性下垂体機能低下症:本剤を中止する。
6). 〈効能共通〉脳炎、髄膜炎:全Grade:本剤を中止する。
7). 〈効能共通〉神経障害:
①. 〈効能共通〉Grade2の神経障害の場合:Grade1以下に回復するまで、本剤を休薬する(12週間を超える休薬後もGrade1以下まで回復しない場合は、本剤を中止する)。
②. 〈効能共通〉Grade3以上の神経障害の場合:本剤を中止する。
③. 〈効能共通〉全Gradeのギラン・バレー症候群:本剤を中止する。
8). 〈効能共通〉重症筋無力症:全Grade:本剤を中止する。
9). 〈効能共通〉皮膚障害:
①. 〈効能共通〉Grade3の皮膚障害の場合:Grade1以下に回復するまで、本剤を休薬する(12週間を超える休薬後もGrade1以下まで回復しない場合は、本剤を中止する)。
②. 〈効能共通〉Grade4の皮膚障害の場合:本剤を中止する。
10). 〈効能共通〉腎炎:
①. 〈効能共通〉血清クレアチニンが基準値上限の1.5倍超かつ3倍以下又は血清クレアチニンがベースラインの1.5倍超かつ3倍以下に増加した場合:Grade1以下に回復するまで、本剤を休薬する(12週間を超える休薬後もGrade1以下まで回復しない場合は、本剤を中止する)。
②. 〈効能共通〉血清クレアチニンが基準値上限の3倍超又は血清クレアチニンがベースラインの3倍超に増加した場合:本剤を中止する。
11). 〈効能共通〉筋炎:
①. 〈効能共通〉Grade2の筋炎又はGrade3の筋炎の場合:Grade1以下に回復するまで、本剤を休薬する(12週間を超える休薬後もGrade1以下まで回復しない場合は、本剤を中止する)。
②. 〈効能共通〉Grade3の筋炎再発又はGrade4の筋炎の場合:本剤を中止する。
12). 〈効能共通〉心筋炎:Grade2以上の心筋炎の場合:本剤を中止する。
13). 〈効能共通〉血球貪食症候群:全Grade:本剤を中止する。
14). 〈効能共通〉眼障害:
①. 〈効能共通〉Grade2の眼障害の場合:Grade1以下に回復するまで、本剤を休薬する(12週間を超える休薬後もGrade1以下まで回復しない場合は、本剤を中止する)。
②. 〈効能共通〉Grade3以上の眼障害の場合:本剤を中止する。
15). 〈効能共通〉Infusion reaction:
①. 〈効能共通〉Grade1のInfusion reactionの場合:投与速度を50%に減速する(なお、軽快した後30分間経過観察し、再発しない場合には投与速度を元に戻すことができる)。
②. 〈効能共通〉Grade2のInfusion reactionの場合:投与を中断し、軽快後に投与速度を50%に減速し再開する。
③. 〈効能共通〉Grade3以上のInfusion reactionの場合:本剤を直ちに中止する。
GradeはNCI-CTCAE(National Cancer Institute-Common Terminology Criteria for Adverse Events)v5.0に準じる。
7.2. 〈化学療法未治療の扁平上皮癌を除く切除不能な進行・再発の非小細胞肺癌〉併用する他の抗悪性腫瘍剤は「17.臨床成績」の項の内容を熟知し選択すること〔17.1.3-17.1.5参照〕。
7.3. 〈化学療法未治療のPD-L1陽性の切除不能な進行・再発の非小細胞肺癌〉化学療法未治療のPD-L1陽性の切除不能な進行・再発の扁平上皮非小細胞肺癌の場合、他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.4. 〈化学療法既治療の切除不能な進行・再発の非小細胞肺癌、PD-L1陽性の非小細胞肺癌における術後補助療法、切除不能な胞巣状軟部肉腫、再発又は難治性の節外性NK/T細胞リンパ腫・鼻型〉他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.5. 〈進展型小細胞肺癌〉カルボプラチン及びエトポシドとの併用に際しては「17.臨床成績」の項の内容、特に、併用する抗悪性腫瘍剤の用法及び用量を十分に理解した上で投与すること〔17.1.7参照〕。
改訂情報
2025年12月10日 DSU No.341 【重要】
【11.1重大な副作用】(追記)
溶血性貧血
2025年11月26日 使用上の注意改訂情報 令和7年11月26日指示分
【11. 副作用-11.1 重大な副作用】(新設)
溶血性貧血
2025年11月5日 DSU No.340 【その他】
【5.効能又は効果に関連する注意】(追記)
〈再発又は難治性の節外性NK/T細胞リンパ腫・鼻型〉
臨床試験に組み入れられた患者の前治療歴等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
【7.用法及び用量に関連する注意】(一部改訂)
〈化学療法既治療の切除不能な進行・再発の非小細胞肺癌、PD-L1陽性の非小細胞肺癌における術後補助療法、切除不能な胞巣状軟部肉腫、再発又は難治性の節外性NK/T細胞リンパ腫・鼻型〉
他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
【9.7小児等】(追記)
〈再発又は難治性の節外性NK/T細胞リンパ腫・鼻型〉
低出生体重児、新生児、乳児、幼児又は12歳未満の小児を対象とした臨床試験は実施していない。ATTACK試験は12歳以上を対象として実施されたが、18歳未満の患者は組み入れられなかった。
2025年4月22日 DSU No.335 【その他】
【6.用法及び用量】(追記)
〈切除不能な胞巣状軟部肉腫〉
通常、成人にはアテゾリズマブ(遺伝子組換え)として1回1200mgを60分かけて3週間間隔で点滴静注する。通常、2歳以上の小児にはアテゾリズマブ(遺伝子組換え)として1回15mg/kg(体重)(最大1200mg)を60分かけて3週間間隔で点滴静注する。なお、初回投与の忍容性が良好であれば、2回目以降の投与時間は30分間まで短縮できる。
【7.用法及び用量に関連する注意】(一部改訂)
〈効能共通〉
本剤投与により副作用が発現した場合には、以下の基準を目安に、本剤の休薬等を考慮すること。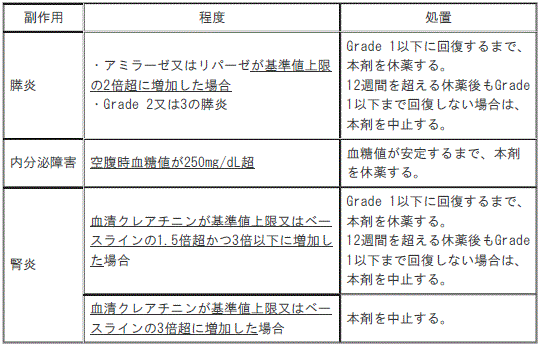
GradeはNCI-CTCAE(National Cancer Institute-Common Terminology Criteria for Adverse Events)v5.0に準じる。
【7.用法及び用量に関連する注意】(一部改訂)
〈化学療法既治療の切除不能な進行・再発の非小細胞肺癌、PD-L1陽性の非小細胞肺癌における術後補助療法、切除不能な胞巣状軟部肉腫〉
他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
【9.7小児等】(追記)
〈切除不能な胞巣状軟部肉腫〉
低出生体重児、新生児、乳児又は2歳未満の幼児を対象とした臨床試験は実施していない。
【11.2その他の副作用】(一部改訂)
【14.適用上の注意】(一部改訂)
[薬剤調製時の注意]
用時調製し、調製後は速やかに使用すること。また、残液は廃棄すること。
2025年3月19日 DSU No.334 【重要】
【11.1重大な副作用】(追記)
免疫性血小板減少症
2025年3月5日 使用上の注意改訂情報 令和7年3月5日指示分
【11. 副作用-11.1 重大な副作用】(新設)
免疫性血小板減少症
医師の処方により使用する医薬品。
特定薬剤管理指導加算等の算定対象となる薬剤。



 で医薬品を比較する
で医薬品を比較する
